Details for a topic
Acides aminés Partie 2
--
All cards
Pourquoi le rôle de l’enzyme est-il indispensable ?
Les réactions sont normalement trop lentes et ne sont pas compatibles avec la durée de vie d’une cellule
Comment est composé de code de l’enzyme ?
EC W.X.Y.Z
EC : synthèse numérique de la commission des enzymes
W : Type de réactoin
X : Substrat général ou groupe de substrat
Y : Substrat spécifique ou la co-enzyme
Z : Numéro de série de l’enzyme
De quelles origines le cofacteur peut-il être ?
- Il est toujours NON PROTEIQUE
- Simple (atome ionisé ou H20)
- Complexe : coenzyme (tjrs non protéique)
Quels sont les 3 types de coenzymes ?
- Oxydoréductrices
- Activatrices
- Groupement prosthétique
2 exemples de coenzymes oxydoréductrices
- NAD : nicotinamide adénine dinucléotide
- co-enzyme Q
2 exemples de coenzymes activatrices
- Co-enzyme A
- Phosphate de pyridoxal
1 exemple de groupement prosthétique
La cobalamine
Avec quelles unités peut-on mesure l’activité enzymatique ?
- Unité internationale : UI.l-1
- Katal : kat.l-1
- Activité absolue (AA)
- Activité Spécifique (AS)
Quelles sont les 3 principales interactions du groupement COOH d’un AA ?
- Activation de l’AA pour la traduction (liaison ester avec ATP puis ARNt)
- Formation de sel
- Décarboxylation
En quelques mots, comment l’acide aminé et avec quoi l’acide aminé se retrouve t-il fixé lors de la traduction
L’ARNt possède un bras se terminant par CAA, auquel l’AA se fixera, et un autre bras avec un anticodon, permettant de se lier au au codon de l’ARNm. L’ARNt, une fois arrimé à l’AA, emmenera ce dernier au ribosome.
Décrire la formation de l’amino-acyl ARNt (formule de la réaction et nom de l’enzyme)
C’est la réaction de liaison covalente entre l’ARNt et l’acide aminé
AA + ARNt + ATP > AA-ARNt + AMP + PPi
- L’AA et l’ATP se lient au site actif de l’amino acyl ARNt synthétase (« étase » car utilise ATP)
- Perte de 2 groupements P (pyrophosphate PPi ou 2Pi si besoin bcp NRJ) par l’ATP qui se lie à l’AA en tant qu’AMP.
- L’ARNt se lie à son site actif et liaison ester entre lui et l’AA, permettant le largage de l’AMP.
- Libération de l’amino-acyl ARNt (AA activé)
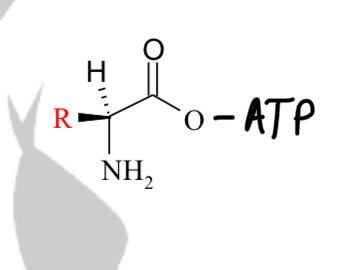
Sur quelles fonctions se forme la liaison Acide aminé / AMP ?
Création d’une fonction ester (covalente) entre COOH de l’AA et le OH en 3’ de l’ose de l’adénosine
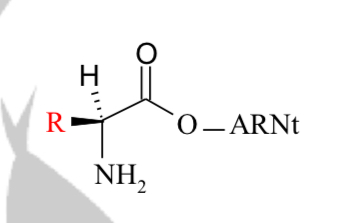
Sur quelles fonctions se forme la liaison entre l’AA et l’ARNt ?
Transformation de la fonction ester covalente entre ATP et AA en ester covalente entre AA et ARNt
Quelle est la formule de formation d’un sel
R-COOH > R-COO- + Cat+ (Cat+ = souvent un métal)
En quoi consiste la décarboxylation ? Grâce à quoi se fait-elle ?
Fait de retirer un groupement carboxyle (COOH) à l’AA, grâce à la L-amino-décarboxylase et à sa coenzyme le phosphate de pyridoxal (forme active de la vitamine B6)
Quel est le besoin journalier exogène en B6 ? Produit-on de la vitamine B6 ?
Aucune production endogène. Besoin de 2 mg/j de B6
Quelle sont les vitamines hydrosolubles
Vitamine C et vitamines B (B1 à B12)
Quelles sont les vitamines liposolubles ?
Vit A,D,E,K
Donnez deux réactions de décarboxylation indispensables
- Transformation de l’histidine en histamine
- Synthèse des catécholamines
Quels sont les 3 rôles de l’histamine ?
- Neurotransmetteur
- Médiateur cellulaire /allergique :
- Production par les mastocytes (vasodilatation des capillaires + inflammation + action sur les récepteurs RH1)
- Production par la flore bactérienne lors d’ingestion de poisson cru
- Responsable de la sécrétion de suc-gastrique par sa liaison avec les récepteurs RH2 (attention, si hypersécrétion HCl : risque d’ulcération)
Quels sont donc les 2 types de médicaments antihistaminiques ?
- Anti-allergie (anti-RH1)
- Anti-ulcéreux (anti-RH2)
Décrire les 4 étapes de la production des catécholamines sans citer les enzymes et cofacteurs
- Tyrosine > L-DOPA (dihydroxyphénylalanine)
- L-DOPA > Dopamine
- Dopamine > Norarénaline
- Noradrénaline > Adrénaline
Enzyme et cofacteurs pour Tyrosine > L-DOPA
Tyrosine hydroxylase + BH4 (Tétrahydrobioptérine)
Enzyme et cofacteur pour L-DOPA > Dopamine
Enzyme décarboxylase des AA aromatiques : L-amino décarboxylase
Cofacteur : Phosphate de pyridoxal (vit. B6 actif)
Enzymes et cofacteur pour Dopamine > Noradrénaline
Dopamine hydroxylase + Vitamine C
Enzyme et cofacteur pour Noradrénaline > Adrénaline
Phényléthanolamine N méthyltransférase
Fonctions de l’adrénaline
Hormone du stress à réponse rapide
- Aug. glycémie par glycogénolyse et lipolyse (triglycérides en AG)
- Orientation du flux sanguin vers organes nobles (coeur, cerveau) pour réponse au stress
- Aug rythme cardiaque, dilatation des bronches, pression arterielle
Etapes de la synthèse de sérotonine
Tryptophane > 5-Hydroxytryptophane : Aide BH4 + tryptophane hydroxylase
5-Hydroxytryptophane > sérotonine : décarboxylase des aa aromatiques (L-amino décarboxylase)
Ecrire la réaction générale COMPLETE de transamination puis la plus courte
AA1 + Phosphate de pyridoxal > AC1 + Phosphate de pyridoxamine
puis
AC2 + phosphate de pyridoxamine > AA2 + phosphate de pyridoxal
AA1 + AC2 > AA2 + AC1 (l’un ne peut aller sans l’autre car création du composé intermédiaire)
Quelle est l’enzyme permettant la transamination
C’est l’amino transférase
Donner deux exemples d’amino transférase et leurs diminutifs
- Alanine amino transférase (ALAT, SGPT)
- Aspartate amino-transférase (ASAT, SGOT)
Donner la réaction type AA1 + AC2 > AA2 + AC1 permise par l’alanine amino-transférase
L-Alanine + alpha céto-glutarate > Pyruvate + L-Glutamate
Donner la réaction type AA1 + AC2 > AA2 + AC1 permise par l’aspartate amino-transférase
L-Aspartate + alpha cétoglutarate > L-Glutamate + acide oxal-acétique
Ou sont retrouvés ces deux amino-transférase ?
Elles sont ubiquitaire (retrouvées partout dans l’organisme) mais surtout dans le foie.
A quoi sert le dosage ALAT et ASAT ?
Si nécrose hépatique légère > libération de l’ALAT contenue dans le cytoplasme, dans le sang.
Si nécrose hépatique sévère (conséquences RAPIDES) > libération ALAT + ASAT contenue dans la mitochondrie, dans le sang.
Qu’est-ce que la désamination ?
Retrait de la fonction AMINE donc libération de NH3 (ammoniac/ammonium) toxique pour l’organisme.
Quelles sont les conséquences physiologiques d’une désamination ?
NH3 est métabolisé (recyclé) dans le foie en Urée
Quelle type d’atteinte fera de la désamination un risque pathologique ?
Si atteinte/anomalie hépatique > plus de métabolisation de NH3 en Urée > hyperammoniémie
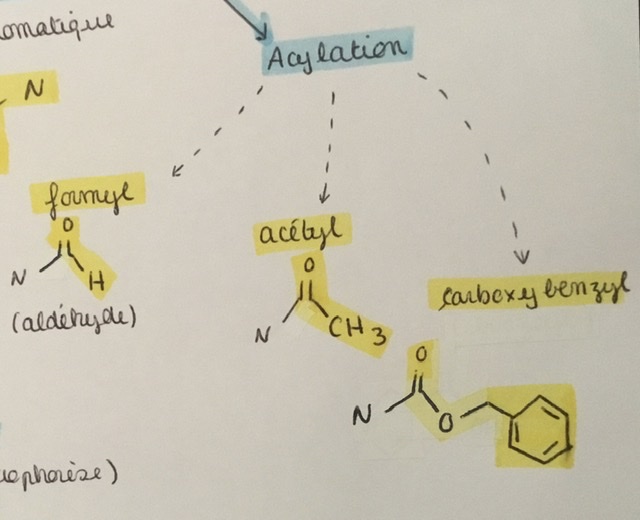
Expliquer la N-alkylation/arylation/acylation
Remplacement d’un des H de NH2 par un radical :
- Groupement aliphatique > alkylation
- Groupement aromatique > arylation
- Formyl, acétyl, carboxybenzyl > acylation
Dessiner un formyl, un acétyl, et un carboxybenzyl
Qu’est-ce que la condensation avec ninhydrine ?
2 molécules ninhydrine + Amino acide (amine prim) > couleur pourpre + destruction de l’AA
2 molécules ninhydrine + Imino acide (amine sec.) > couleur jaune + destruction de l’AA
Quelles applications pour cette condensation ?
Empreintes digitales, dosage à 10-9 mol/L (nano)
Qu’utilise t-on maintenant à la place de la ninhydrine pour le dosage ?
La fluorexamine car sensibilité au pico près (10-12 mol/L)
Qu’est-ce qu’un groupement prosthétique ?
Il s'agit d'un composé organique non protéique maintenu dans une structure protéique au moyen de liaisons covalentes permanentes, mais aussi éventuellement de liaisons faibles. Les groupements prosthétiques appartiennent à plusieurs catégories moléculaires.
Quelle va être la conséquence clinique de l’hyperammionémie ?
Troubles de la conscience.
Rôle de la vitamine A et son nom sous forme de cofacteur
Rétinol ou acide rétinoïque, impliqué dans le processus de la vision
Rôle de la vitamine D
Métabolisme osseux +++
Rôle vitamine E
Antioxydant
Rôle vitamine K
Impliqué dans la formation des caillots sanguins : hémostase.
Qu’est-ce que la céto-acide décarboxylase ?
C’est l’enzyme capable de décarboxyler un acide alpha-céto ramifié : c’est à dire dans le cas de ce cours un acide aminé ayant subit une transamination